dr inż. Joanna Żebrowska1
dr hab. Dorota Witkowska, prof. UWM2
1Zakład Higieny Weterynaryjnej w Olsztynie
2Uniwersytet Warmińsko-Mazurski w Olsztynie, Katedra Higieny Zwierząt i Środowiska
Skażenia mikrobiologiczne jaj wylęgowych stanowią ważny problem w produkcji drobiu, którego efektem mogą być słabsze wskaźniki wylęgowości oraz wydajności piskląt. Oczywisty jest fakt, że należy zachować wysokie standardy higieny w wylęgarniach drobiu, aby zminimalizować zabrudzenia jaj, jednak dalsza ich dezynfekcja jest również konieczna, w celu ograniczania liczby drobnoustrojów. Bakterie znajdujące się na powierzchni jaj wylęgowych mogą potencjalnie przenikać do skorupy poprzez pory lub ubytki strukturalne i tym samym zanieczyszczać wnętrza jaj. Może to skutkować zakażeniem rozwijającego się zarodka, co może doprowadzić nawet do ich śmierci.

Stąd też ograniczenia występowania drobnoustrojów na skorupce jaj wylęgowych poprzez zastosowanie tradycyjnych i alternatywnych metod dezynfekcji, może potencjalnie zapobiec pogorszeniu się wybranych wskaźników wylęgowości jaj. Dezynfekcję wykonuje się metodą suchą (fumigacja), którą przeprowadza się bezpośrednio po zbiorze jaj, a następnie pozostawia się je w suchym i czystym magazynie, gdzie zapewnia się temperaturę przechowywania 13-15°C oraz wilgotność względną 75%. Ponowną dezynfekcję wykonuje się przed włożeniem jaj wylęgowych do komory lęgowej inkubatora (Kubaczyński i in. 2016). Drugą stosowaną metodą jest metoda mokra, która polega na oprysku lub zanurzeniu skorupki jaj w odpowiednim roztworze środka dezynfekcyjnego (Oliveira i in. 2021). W tabeli 1 przedstawiono analizę wybranych metod dezynfekcji jaj wylęgowych.
Tradycyjne metody dezynfekcji jaj
Popularną metodą stosowaną w tradycyjnej dezynfekcji jaj wylęgowych jest fumigacja mieszaniną formaliny z nadmanganianem potasu w stosunku 2:1. Formaldehyd jest łatwo rozpuszczalnym w wodzie związkiem, o ostrej i nieprzyjemnej woni. Skuteczność przeciwdrobnoustrojowa formaldehydu wynika z jego zdolności do oddziaływania na białka i zasady kwasów nukleinowych mikroorganizmów, hamując tym samym ich wzrost (Oliveira i in. 2021). Jak podaje Cadirci (2008) w celu skutecznej dezynfekcji jaj, konieczne jest stosowanie formaldehydu w stężeniach odpowiednich do czasu ekspozycji. Czynniki takie jak wielkość komory fumigacyjnej, czas ekspozycji, temperatura i wilgotność wpływają na ilość formaldehydu niezbędną do przeprowadzanie odpowiedniej fumigacji. Jego wysoki potencjał bakteriobójczy został potwierdzony przez kilku autorów. Chung i in. (2018) w badaniach własnych po zastosowaniu fumigacji formaldehydem zaobserwowali istotną redukcję liczby tlenowych bakterii mezofilnych na skorupce jaja (z 4,66±0,08 do 2,33±0,10 log10 CFU/skorupę jaja). Z kolei Pereira i in. (2018) zaobserwowali, że fumigacja jaj wylęgowych paraformaldehydem znacząco zmniejszyła liczbę wszystkich tlenowych bakterii mezofilnych w skorupce z 3,00±0,72 do 2,36±0,87 przy log10 CFU/g oraz z 4,80±0,72 do 3,92±1,50 przy log10 CFU/jajo. Clímaco i in. (2018) wykazali również, że fumigacja paraformaldehydem (1,10±0,16 log10 CFU/ml) w odróżnieniu od innych środków dezynfekcyjnych znacząco zmniejszyła liczbę wszystkich tlenowych bakterii mezofilnych na skorupce jaj wylęgowych. Należy mieć na uwadze, że oprócz silnych właściwości przeciwdrobnoustrojowych formaldehydu, jest on szkodliwy dla zdrowia ludzkiego. Jest to związek toksyczny, silnie drażniący i uczulający, dlatego podczas jakichkolwiek działań z jego użyciem należy unikać bezpośredniego z nim kontaktu poprzez zastosowanie odpowiedniej odzieży ochronnej.
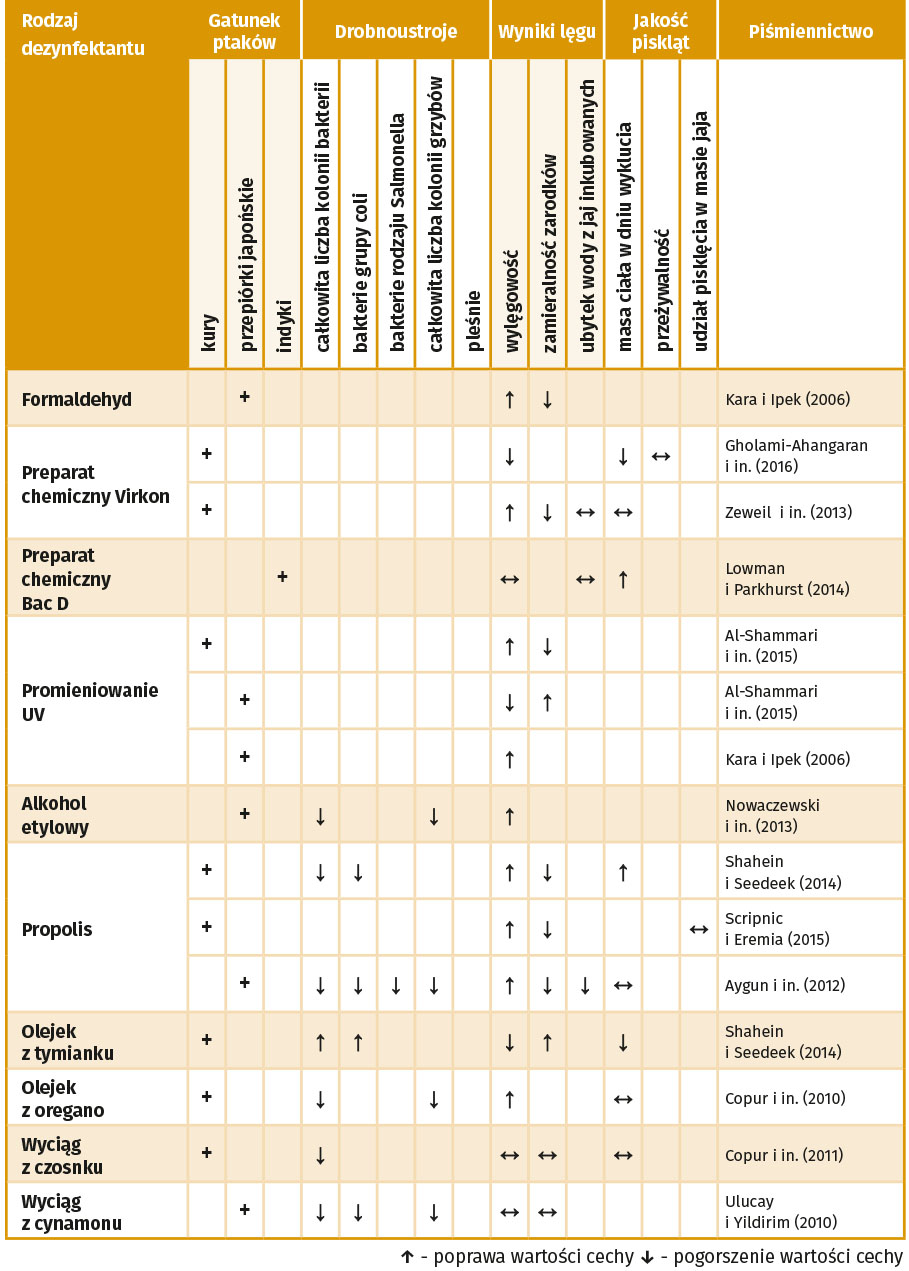
Tabela 1. Efektywność wybranych metod dezynfekcji jaj wylęgowych
Alternatywne metody dezynfekcji jaj
Reaktywne formy tlenu
Ozon (O3) jest wysoce reaktywną cząsteczką wykazującą zdolności utleniające, a jego mechanizm działania polega na degradacji błony komórkowej bakterii oraz na peroksydacji składników komórki (Wlazło i in., 2020). Jak podaje Kubaczyński i in. (2016) w dezynfekcji jaj wylęgowych ozonowanie uważa się za metodę bardziej bezpieczną w porównaniu z powszechnie stosowanym formaldehydem, który wykazuje właściwości drażniące i toksyczne dla ludzi. Jednakże badania Wlazło i in. (2020) nad stosowaniem reaktywnych form tlenu w dezynfekcji jaj wylęgowych przepiórek japońskich wykazały znaczne pogorszenie wyników wylęgowych ptaków w grupie dezynfekowanej O3, zwiększoną śmiertelność oraz większą utratę masy jaj podczas ich inkubacji. Ponadto Furhmnann i in. (2010) zaobserwowali, iż w wyniku ozonowania jaj wylęgowych, w dużej dawce O3, uzyskano znaczącą modyfikację ich składu tj. mniejszą zawartość witaminy E w żółtku jaj oraz zmianę profilu kwasów tłuszczowych.
Nadtlenek wodoru (H2O2) jest bezbarwną, bezwonną cieczą o właściwościach silnie utleniających, tworzącą wolne rodniki, których działanie prowadzi do zmiany struktury oraz funkcji błony komórkowej. Badania naukowe wskazują, iż w porównaniu do tradycyjnej fumigacji formaldehydem dezynfekcji jaj wylęgowych stosowanie metod alternatywnych z zastosowaniem, do reaktywnych form tlenu nie przyczynia się w znaczący sposób do zmniejszenia liczby kolonii bakterii na skorupkach jaj wylęgowych. Melo i in. (2019) wykazali, iż najmniejszą redukcję całkowitej liczby mezofilnych bakterii tlenowych oraz bakterii z rodzaju Enterobacteriaceae uzyskano po zastosowaniu ozonowania i nadtlenku wodoru w stosunku do pozostałych metod dezynfekcji (promieniowanie UV, fumigacja paraformaldehydem oraz roztworem kwasu octowego). Te wyniki są zgodne z wynikami Keita i in. (2016), którzy wykazali, iż dezynfekcja jaj przy użyciu H2O2 (6%) nie była w stanie zredukować populacji bakterii tlenowych na skorupce jaj. Mimo że wyżej wspomniane metody wydają się mniej skuteczne w dezynfekcji, badania Wlazło i in. (2020) wskazują, iż O3 przyczynia się do redukcji niektórych patogennych bakterii tj. Staphylococcus aureus, Bordetella spp. Z kolei H2O2 redukuje liczbę bakterii z rodzaju Salmonella.
Promieniowanie UV
Jedną z powszechnych, a zarazem skutecznych metod dezynfekcji jaj wylęgowych, jest metoda naświetlania powierzchni skorup jaj promieniowaniem ultrafioletowym (UV). Wyróżnia się 3 zakresy długości fal tego promieniowania: UV-C (100-280 nm), UV-B (280-315 nm) oraz UC-A (315-400 nm), przy czym w praktyce, w dezynfekcji jaj wylęgowych, wykorzystuje się promieniowanie UV-C, które charakteryzuje się wysoką skutecznością zwalczania mikroorganizmów poprzez uszkadzanie łańcuchów DNA. Ponadto, promieniowanie UV-C o długości fali 254 nm słabo przenika w ośrodkach nieprzejrzystych, stąd też może być ono stosowane do sterylizacji powierzchniowej produktów spożywczych. Uzyskane wyniki badań wielu autorów dowodzą, iż promieniowanie UV-C jest bezpieczną metodą w dezynfekcji jaj wylęgowych (Al-Shammari i in. 2017). Badania Szablewskiego i in. (2009) nad wpływem promieniowania UV na stan mikrobiologiczny skorupy oraz jakość jaj kurzych wykazały, iż naświetlanie jaj promieniowaniem UV-C 254 nm przez 30s i 90s powoduje redukcję komórek bakteryjnych na powierzchni skorupy, zaś w połączeniu z procesem mycia skutecznie usuwa bakterie z grupy coli. Wykazano przy tym, iż promieniowanie UV-C 254 nm nie wpływa na zmiany składu jaj. W badaniach Melo i in. (2019) promieniowanie UV-C charakteryzowało się większą skutecznością w stosunku do bakterii z rodzaju Enterobacteriaceae niż wobec innych bakterii tlenowych oraz pleśni i drożdży.
Nanocząsteczki srebra
W ostatnich latach nanocząsteczki srebra znalazły szerokie zastosowanie w dezynfekcji jaj wylęgowych. Mechanizm bakteriobójczego działania nanocząsteczek srebra może mieć charakter wielokierunkowy. Jak podają Pejsak i Tarasiuk (2021) im mniejsza nanocząsteczka, tym większa jej aktywność. W połączeniu ze ścianami komórkowymi bakterii nanocząsteczki stopniowo uwalniają jony srebra, które po wniknięciu do wnętrza komórki uszkadzają materiał genetyczny. Ponadto, aktywne formy srebra prowadzą do zaburzeń w procesie rekombinacji i replikacji materiału genetycznego poprzez defosforylację reszt tyrozynowych. Większość drobnoustrojów wykazuje wysoką wrażliwość na działanie nanocząsteczek, nie wytwarzając przy tym oporności w stosunku do srebra. Badania Batkowskiej i in. (2017) nad zastosowaniem srebra koloidalnego w dezynfekcji jaj wylęgowych potwierdziły jego właściwości przeciwdrobnoustrojowe, w tym głównie ograniczyły liczbę bakterii z rodzaju Staphylococcus. Obok Gram-dodatnich (G+) ziarenkowców (Staphylococcus sp., Enterococcus sp.) wśród bakterii tlenowych mezofilnych wrażliwych na działanie nanocząsteczek srebra znaczącą grupę stanowiły bakterie Gram-ujemne (G-) z rodziny Enterobacteriaceae: Escherichia coli, Salmonella sp., Klebsiella sp., jak i wiele innych: Pseudomonas sp. czy Acinetobacter sp. (Drabik i Batkowska, 2020).
Lekko kwaśna woda elektrolizowana (SAEW)
Lekko kwaśna woda elektrolizowana uznana jest za skuteczny środek dezynfekcyjny do sterylizacji jaj wylęgowych ze względu na jej szerokie spektrum działania i wysoką skuteczność. Główną aktywną formą związków chloru w SAEW jest kwas podchlorawy (HOCl), który wykazuje silne działanie przeciwdrobnoustrojowe.
Lekko kwaśna woda elektrolizowana okazała się obiecującym środkiem do dezynfekcji jaj wylęgowych bez większego wpływu na wzrost zanieczyszczeń środowiska. Badania Liu i in. (2022) wykazały, że skuteczność sterylizacji jaj z wykorzystaniem SAEW wzrasta wraz ze wzrostem stężenia chloru, objętością oprysku oraz czasem trwania sterylizacji. Ponadto na skorupkach jaj zaobserwowano redukcję mikrobiologiczną o 23,48 x 103 CFU/jajko. Dezynfekcja jaj lekką kwaśną wodą elektrolizowaną przez 3 i 4 min spowodowała całkowitą inaktywację Salmonella Enteritidis oraz Escherichia coli. Badania dowiodły również, że zastosowanie SAEW nie wpłynęło na wytrwałość i grubość skorupki, stąd też środek ten może stanowić alternatywę dla konwencjonalnych chemicznych środków dezynfekcyjnych takich jak bromek benzalkoniowy.
Naturalne preparaty
W przypadku alternatywnych metod dezynfekcji jaj wylęgowych coraz większym zainteresowaniem cieszą się substancje naturalne. Cechują się one nie tylko silnymi właściwościami przeciwbakteryjnymi, ale także działaniem przeciwgrzybiczym, przeciwwirusowym czy też antyoksydacyjnym. Wśród naturalnych środków należy wymienić m.in. czosnek. Głównym jego składnikiem decydującym o przeciwbakteryjnych właściwościach jest allina, która w efekcie przemian enzymatycznych przekształca się do allicyny. Badania Baylan i in. (2018) potwierdzają pozytywny efekt dezynfekcji jaj po zastosowaniu preparatu na bazie czosnku, która wpłynęła na większą masę ciała przepiórek japońskich w czasie odchowu oraz mniejszy wskaźnik ich śmiertelności. Stosowanie ekstraktu z czosnku do dezynfekcji jaj wylęgowych nie wykazało żadnego negatywnego wpływu na rozwój zarodków oraz parametry wylęgu. Innym preparatem naturalnym wykorzystywanym w dezynfekcji jaj jest olejek z oregano. Karwakrol, tymol, terpinen oraz p-cymen, które są głównymi składnikami olejku z oregano wykazują szerokie działanie przeciwdrobnoustrojowe. Copour i in. (2010), badając wpływ fumigacji jaj wylęgowych z chowu stad rodzicielskich brojlerów wspomnianym olejkiem, zaobserwowali redukcję całkowitej liczby bakterii, drożdży i pleśni na powierzchni skorupek jaj. Autorzy stwierdzili również, że zastosowanie olejku z oregano nie miało szkodliwego wpływu na rozwijający się zarodek, co zgadza się z wynikami wcześniejszych badań prowadzonych przez Yildirim i in. (2003). W dodatku fumigacja olejkiem poprawia wylęgowość, co może być bezpośrednim skutkiem zmniejszonej liczby drobnoustrojów. Podobne wyniki badań opublikował Gamal (2019), który prowadził badania nad wpływem m. in. środka dezynfekcyjnego na bazie oregano oraz oregano + kminek na wskaźniki wylęgowe i zarodki piskląt kurzych. Aby uzyskać najlepsze wyniki autor zaleca stosowanie naturalnego środka z oregano 0,4% oraz oregano + kminek 0,1%. Z kolei Tebrün i in. (2020) odkażali jaja wylęgowe różnymi preparatami w celu oceny ich wpływu na wylęgowość i zdrowotność piskląt brojlerów. Wykazali, że zastosowanie preparatu na bazie różnych olejków eterycznych w postaci spreju ma negatywny wpływ na wylęgowość jaj i nie nadaję się do przetestowania w terenie. Wyjaśnieniem zmniejszonego wskaźnika wylęgowości jaj była zbyt oleista konsystencja środka dezynfekcyjnego, która doprowadziła do zatkania porów skorupy jaj, co prawdopodobnie skutkowało zmniejszoną utratą wilgoci oraz zmniejszoną podażą tlenu dla zarodków kurzych. Dlatego też istotne jest zapewnienie odpowiednich parametrów stosowania środków dezynfekcyjnych na bazie olejków eterycznych w celu dezynfekcji jaj wylęgowych, takichjak czas stosowania i stężenia środka dezynfekcyjnego, aby zapobiec negatywnemu wpływowi na wylęgowość. Badania Batkowskiej i in. (2018) wykazały skuteczność soku GT jako środka dezynfekcyjnego do fumigacji jaj wylęgowych, który ograniczył rozwój mikroflory w skorupce jaj. Jego zastosowanie nie wpłynęło bezpośrednio na wyniki wylęgu i zdrowotność piskląt przepiórek japońskich, co może świadczyć o możliwości wykorzystania soku z czerwonego grejpfruta w praktyce jako alternatywnej metody dezynfekcji.
Podsumowując powyższe zestawienie, można stwierdzić, że tradycyjne, jak i alternatywne metody dezynfekcji jaj wylęgowych wykazują różne mechanizmy i skuteczność działania. Formaldehyd jest szeroko stosowany jako konwencjonalny, chemiczny środek dezynfekcyjny, jednak badania określające skuteczność alternatywnych rozwiązań w tym z zastosowaniem naturalnych preparatów do dezynfekcji jaj wylęgowych, być może pozwolą na ograniczenie stosowania syntetycznych chemikaliów, a tym samym zmniejszenie ich niepożądanych skutków.
Literatura
1. Kubaczyński A., Widz P., Batkowska, J. 2016. Dezynfekcja jaj wylęgowych–tradycje i innowacje.[W:] Ergonomia, bezpieczeństwo i higiena pracy w praktyce. Nowakowicz-Dębek B., Pawlak H.(red.), Towarzystwo Wydawnictw Naukowych Libropolis, Lublin, s. 243-253.
2. Oliveira G.D.S., dos Santos V.M., Nascimento S.T. 2021. Essential oils as sanitisers for hatching eggs. World’s Poultry Science Journal, 77(3): 605-617.
3. Cadirci S. 2009. Disinfection of hatching eggs by formaldehyde fumigation–a review. Archiv für Geflügelkunde, 73(2):116-123.
4. Chung H., Kim H., Myeong D., Kim S. Choe N.H. 2018. Effect of chlorine dioxide gas application to egg surface: microbial reduction effect, quality of eggs, and hatchability. Korean journal for food science of animal resources, 38(3): 487-497.
5. Pereira F.M.A.M., de Sousa L.P.V.G., Rama J.D., Dallago B.S.L., Perecmanis S. Bernal F.E.M. 2018. Efeito da luz ultravioleta na eclodibilidade e viabilidade de pintos provenientes de ovos férteis sujos. Revista Brasileira de Ciência Veterinária, 25(3/4): 87-92.
6. Clímaco W.L.D.S., Melo É.D.F., Vaz D.P., Saldanha M.M., Pinto M.F.V.D.S., Fernandes L.C.C., Baião N.C., Oliveira L.G.D., Sant’Anna F.M.D., Souza M.R.D., Lara L.J.C. 2018. Eggshell microbiology and quality of hatching eggs subjected to different sanitizing procedures. Pesquisa Agropecuária Brasileira, 53: 177-1183.
7. Wlazło L., Drabik K., Al-Shammari K.I., Batkowska J., Nowakowicz-Debek B., Gryzińska M. 2020. Use of reactive oxygen species (ozone, hydrogen peroxide) for disinfection of hatching eggs. Poultry Science, 99(5): .2478-2484.
8. Fuhrmann H., Rupp N., Büchner A., Braun P. 2010. The effect of gaseous ozone treatment on egg components. Journal of the Science of Food and Agriculture, 90(4): 593-598.
9. Melo E.F., Clímaco W.L.S., Triginelli M.V., Vaz D.P., de Souza M.R., Baião N.C., Pompeu M.A., Lara, L.J.C. 2019. An evaluation of alternative methods for sanitizing hatching eggs. Poultry science, 98(6): 2466-2473.
10. Keita A., Huneau-Salaün A., Guillot A., Galliot P., Tavares M., Puterflam J. 2016. A multi-pronged approach to the search for an alternative to formaldehyde as an egg disinfectant without affecting worker health, hatching, or broiler production parameters. Poultry Science, 95(7): 1609-1616.
11. Szablewski T., Kijowski J., Cegielska-Radziejewska R., Dziedzic A., Kamińska, A. 2009. Wpływ promieniowania UV na stan mikrobiologiczny skorupy oraz jakość treści jaj. Żywność Nauka Technologia Jakość, 16(2): 40-52.
12. Al-Shammari K.I., Batkowska J., Gryzińska M.M. 2017. Assessment of ultraviolet light effect in hatching eggs disinfection on hatchability traits of two breeds of quails and chickens. Acta Scientiarum Polonorum Zootechnica, 14(2): 33-44.
13. Pejsak Z., Tarasiuk K. 2021. Wykorzystanie aktywnych form srebra w dezynfekcji. Medycyna Weterynaryjna, 77(5): 221-225.
14. Batkowska J., Al-Shammari K.I.A., Gryzinska M.M., Brodacki A., Wlazło, L., Nowakowicz-Debek B. 2017. Effect of using colloidal silver in the disinfection of hatching eggs on some microbial, hatchability and performance traits in Japanese quail (Coturnix cot. japonica). European Poultry Science, 81: 1-11.
15. Drabik K., Batkowska J. 2020. Tradycyjne i alternatywne metody dezynfekcji jaj wylęgowych, cz. I. Polskie Drobiarstwo, (01).
16. Liu C., Zheng W., Li Z., Zhou L., Sun Y., Han S. 2022. Slightly acidic electrolyzed water as an alternative disinfection technique for hatching eggs. Poultry Science, 101(3): 1-8.
17. Copur G., Arslan M., Duru M., Baylan M., Canogullari S., Aksan E. 2010. Use of oregano (Origanum onites L.) essential oil as hatching egg disinfectant. African Journal of Biotechnology, 9(17): 2531-2538.
18. Yildirim I., Ozsan M., Yetisir R. 2003. The use of oregano (Origanum vulgare L) essential oil as alternative hatching egg disinfectant versus formaldehyde fumigation in quails (Coturnix coturnix japonica). Revue de médecine vétérinaire, 154(5): 367-370.
19. Tebrün W., Motola G., Hafez M.H., Bachmeier J., Schmidt V., Renfert K., Reichelt C., Brüggemann-Schwarze S., Pees M. 2020. Preliminary study: Health and performance assessment in broiler chicks following application of six different hatching egg disinfection protocols. Plos one, 15(5): 1-24.
20. Batkowska J., Wlazło L., Drabik K., Nowakowicz-Debek B., Al-Shammari K.I., Gryzińska M. 2018. Evaluation of grapefruit juice (Citrus paradisi) as an alternative disinfectant for hatching eggs. Pakistan Journal of Zoology, 50(2): 647-653.
21. Kara H., Ipek A. 2006. The effect of ultraviolet light application on hatchability parameters of Japanese quail eggs (Coturnix coturnix japonica). In CD-Rom Abstr. and Proc. of XII Europ. Poul. Conf., Verona, Italy (No. 10191).
22. Al-Shammari K.I.A., Batkowska J., Gryzinska M.M. 2015. Assessment of ultraviolet light effect in hatching eggs disinfection on hatchability traits of two breeds of quails and chickens. Acta ScientiarumPolonorum. Zootechnica, 14(2): 33-44.
23. Gholami-Ahangaran M., Shahzamani S., Yazdkhasti M. 2016. Comparison of virkon S (r) and formaldehyde on hatchability and survival rate of chicks in disinfection of fertile eggs. Revue. Médecine Vétérinaire, 167(1-2): 45-49.
24. Zeweil H.E., Rizk R.E., Bekhert G.A.H., Mona, Ahmed R.M. 2013. Effect of egg disinfection of hatching perfomrance for Bandarahan chicken strain. Egyptian Poultry Science, 33(2): 289-307.
25. Lowman Z., Parkhurst C. 2014. Effect of Bac-D™ on hatchability, conductance, growth rate and feed conversion on turkey poults. International Journal of Poultry Science, 13(2): 97-101.
26. Nowaczewski S., Szablewski T., Cegielska-Radziejewska R. and Kontecka H. 2013. Microbiological response of Japanese quail eggs to disinfection and location in the setter during incubation. Folia Biologica (Kraków), 61(1-2):119-124.
27. Shahein E.H.A., Seedeek E.K. 2014. Role of spraying hatching eggs with natural disinfectants on hatching characteristics and eggshell bacterial counts. Egyptian Poultry Science, 34 (1): 213-230.
28. Copur, G., Arslan, M., Baylan, M., Canogullari, S. (2011). Use of allicin as an alternative hatching egg disinfectant versus formaldehyde fumigation in broiler hatching eggs. Biotechnology & Biotechnological Equipment, 25(3), 2494-2498.
29. Copur G., Arslan M., Duru M., Baylan M., Canogullari S., Aksan E. 2010. Use of oregano (Origanumonites L.) essential oil as hatching egg disinfectant. African Journal of Biotechnology, 9(17): 2531-2538.
30. Ulucay I.O., Yildirim I. 2010. Hatching traits of quail (Coturnixcoturnix japonica) eggs disinfected with carvacrol, cinnamaldehyde or thymol. Journal of Applied Animal Research, 38(1): 139-142.
31. Scripnic E., Eremia, N. 2015. Propolis extract use din incubation technology for hens’ eggs treatment.
32. Aygun A., Sert D., Copur G. 2012. Effects of propolis on eggshell microbial activity, hatchability, and chick performance in Japanese quail (Coturnix coturnix japonica) eggs. Poultry Science, 91(4): 1018-1025.





