Dr inż. Alina Rachwał
Rozpoznawanie chorób inwazyjnych powinno być przeprowadzane ze szczególnym uwzględnieniem badań laboratoryjnych. Badanie sekcyjne daje podstawę do określenia stopnia zarobaczenia oraz zmian nim wywołanych. Pozwala także na łatwe określenie gatunku pasożyta (rys. 1).
Dla uniknięcia pomyłek co do lokalizacji pasożytów bada się poszczególne odcinki przewodu pokarmowego lub narządy w oddzielnych naczyniach z wodą lub płynem fizjologicznym. Badanie kału na obecność jaj robaków pasożytniczych przeprowadza się:
- metodą flotacji – jak w badaniach na obecność oocyst poszczególnych kokcydiów,
- uproszczoną metodą Stolla.

Rys. 1. Umiejscowienie pasożytów przewodu pokarmowego kury: 1 – Acuaria spiralis, 2 – A. hamulosa, 3 – Eucoleus annulatus, 4 – Capillaria caudinflata, 5 – C. obsignata, 6 – C. retusa, 7 – Davainea proglottina, 8 – Ascaridia galli, 9 – Raillietina tetragona, 10 – R. cesticillus, 11 – Echinoparyphium recurvatum, 12 – Prosthogonimus ovatus, 13 – Heterakla gallinarum.
Tab 1. Najważniejsze dane dotyczące oocyst różnych gatunków kokcydiów występujących u kury


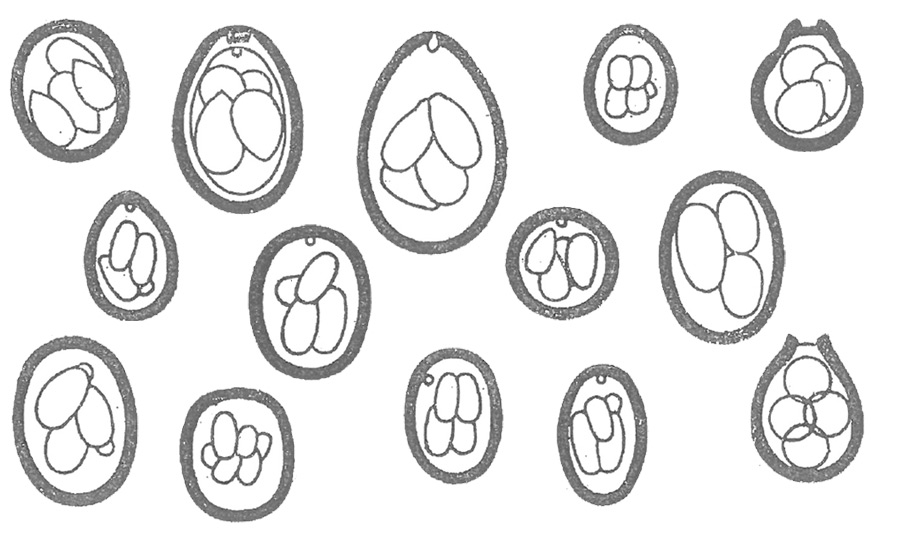
Rys. 2. Schematyczne przedstawienie wielkości i kształtu oocyst kokcydiów:
a) Eimeria tenella, b) E. necatrix, c) E. mitis, d) E. acervulina, e) E. maxima, f) E. praecox, g) E. mivati, h) E. hagani, i) E. brunetti, j) E. dispersa, k) E. truncata, l) E. anseris, m) E. nocens, n) E. columbarum.
Tab. 2. Najważniejsze dane dotyczące jaj robaków pasożytujących u drobiu

Charakterystyczne cechy oocyst poszczególnych kokcydiów przedstawia tabela 1 oraz rysunek 2.
Charakterystyczne cechy najczęściej spotykanych jaj przedstawiono w tabeli 2. Ujemny wynik badania kału na obecność jaj robaków pasożytniczych nie daje podstawy do twierdzenia, że ptak nie jest zarażony. Brak jaj w kale może wynikać z pobrania kału w okresie preimaginalnym, to znaczy w stadium niedojrzałego płciowo pasożyta, albo z nieobecności jaj tylko w danej próbce kału /nierównomierne rozmieszczenie jaj/. Na składanie jaj przez pasożyta wywiera wpływ wiele czynników, jak na przykład pory dnia i roku, jakość pożywienia żywiciela, stany zapalne przewodu pokarmowego itd. Łatwiej jest znaleźć jaja w treści pochodzącej z jelita cienkiego niż w kale z jelit ślepych, gdyż jest on gęsty, kleisty i trudno rozpuszczalny w nasyconym roztworze soli kuchennej.
Zapobieganie Chorobom INWAZYJNYM
Ochrona stad przed zarażeniem
Do stad zdrowych nie należy dołączać ptaków pochodzących ze stad zarażonych, gdyż mogą one być nosicielami robaków pasożytniczych. Przyczyną zawleczenia chorób inwazyjnych mogą być także ptaki dzikie (wróble, szpaki, wrony, ptaki wodne). Wybuch syngamozy często ma swą przyczynę w zanieczyszczeniu środowiska kałem ptaków· dzikich, zawierającym jaja SYNGAMUS TRACHEA.
Szczególną uwagę należy zwracać na oddzielny wychów młodzieży bez możliwości kontaktu z osobnikami dorosłymi, które bardzo często są nosicielami, nie wykazując objawów klinicznych. Wspólna hodowla wielu gatunków ptaków jest także niewskazana. Na przykład u indyków utrzymywanych wspólnie z kurami częściej występuje zakaźne zapalenie wątroby i jelit ślepych (czarna główka), gdyż kury są nosicielami heterakis gallinarum, w którego jajach przebywają pierwotniaki histomonas meleagridis, wywołujące tę chorobę. Jaja robaków i oocysty kokcydiów mogą być przenoszone również mechanicznie przez człowieka, ptaki
i gryzonie.
Środowisko
Środowisko, w którym przebywa drób może być siedliskiem żywicieli rezerwuarowych, w których organizmie inwazyjne larwy mogą przebywać nawet przez kilka lat. Żywiciele rezerwuarowi odgrywają znaczną rolę w rozprzestrzenianiu streptokarozy kaczek (ryby) i syngamozy (dżdżownice, wije, ślimaki, owady). Jeszcze większą rolę odgrywają żywiciele pośredni. Na przykład dżdżownice są żywicielami pośrednimi Capillaria, dafnie Echinurja, kiełże – Streptocara i Tetrameres, ślimaki, chrząszcze, mrówki, skorupiaki – Cestodes, ślimaki i ważki – Trematodes.
Żywicielami rezerwuarowymi i pośrednimi są najczęściej zwierzęta wodne i środowisk wilgotnych. Należy więc unikać zakładania ferm na terenach sprzyjających bytowaniu tych żywicieli (podmokłe pastwiska, zarośnięte brzegi jezior i rzek, błotniste stawy).
Wybiegi powinny być urządzane na glebach przepuszczalnych, suchych i nasłonecznionych. Nie wolno dopuszczać do wyrastania na wybiegach wysokich roślin (chwastów). Trawę trzeba nisko kosić, gdyż, wysokie rośliny sprzyjają przetrwaniu larw i jaj, chronią je przed wysychaniem i działaniem promieni słonecznych.
Trudności w ustrzeżeniu ptaków od zarażeń na wybiegach skłaniają hodowców do zakładania wybiegów o utwardzonej powierzchni (nawet cementowej), którą łatwo oczyścić i odkazić.
Aby zapobiec zarażeniu ptaków na wybiegach stosuje się regularną zmianę kwater. Na kwaterę używaną ptaki mogą powrócić dopiero po roku lub po przezimowaniu. W tym czasie larwy inwazyjne i jaja, pozbawione żywicieli giną. W zapobieganiu niektórym chorobom można ten okres skrócić. Na przykład przy askarydiozie powtórne wykorzystanie kwater może mieć miejsce po 6.- 12. tygodniach w zależności od warunków klimatycznych.
W zapobieganiu chorobom inwazyjnym stosuje się także częste zmiany kwater, wykorzystując dość długie okresy rozwoju larw inwazyjnych w jajach. Na przykład czas ten dla larw Capillaria obsignata wynosi 7 – 8 dni, a dla Thominxcont contorta 21 dni., Jeżeli zmiany kwater dokonywać się będzie co 6 dni, to nie dojdzie do zarażenia ptaków przez Coobsignata, a przy zmianach kwater co 20 dni – przez Thominxcontorta.
W zapobieganiu amidostomatozis zaleca się zmianę kwater co 4 dni, gdyż 5. dnia rozwijają się larwy inwazyjne. W zapobieganiu glistnicy zmianę wybiegów w zależności od warunków klimatycznych stosuje się co 12 – 30 dni, a w zapobieganiu heterakidozie
– co 5 – 14 dni. Wybiegi powinny być wiosną i latem przeorane i przez 1 – 2 tygodnie nie należy wypuszczać na nie drobiu.





